摘要
背景
在最近的抗淀粉样蛋白-β (Aβ)免疫治疗试验中,淀粉样蛋白相关成像异常(ARIA)已被确定为由脑血管系统病理改变引起的最常见和最严重的不良事件。然而,淀粉样蛋白免疫治疗如何增强脑淀粉样血管病(CAA)介导的血管通透性和微出血改变的精确细胞和分子机制目前尚不清楚。有趣的是,脑血管周围巨噬细胞参与调节CAA沉积和脑血管功能,然而,需要进一步的研究来了解血管周围巨噬细胞如何在淀粉样蛋白免疫治疗相关的CAA相关血管通透性和微出血中发挥作用。
方法
在这项研究中,我们通过对阿尔茨海默病(AD)小鼠模型和原代培养系统的组织学和基因表达分析,检测了淀粉样蛋白靶向抗体和caa诱导的微出血诱导的免疫反应。
结果
在本研究中,我们证明了抗a β (3D6)免疫治疗导致血管淀粉样蛋白沉积形成抗体免疫复合物,并诱导CD169+血管周围巨噬细胞的活化。我们发现被抗体介导的Fc受体信号激活的巨噬细胞在体外增加了炎症信号和细胞外基质重塑基因Timp1和MMP9的表达,并在体内证实了这些关键发现。最后,我们证明了血浆蛋白的血管通透性增强和血管淀粉样蛋白沉积物周围炎症单核细胞的募集,这与脑微出血中的含铁血黄素沉积有关,表明激活的血管周围巨噬细胞在响应Aβ免疫治疗中的多维作用。
结论
总之,我们的研究建立了参与CAA沉积物的a β抗体、血管周围巨噬细胞的激活和参与血管通透性的基因上调之间的联系。然而,这种现象对微出血易感性的影响仍有待充分阐明。需要进一步的研究来确定CD169 +血管周围巨噬细胞在增强caa介导的血管通透性、血浆蛋白外渗和与微出血相关的免疫细胞浸润中的确切作用。
介绍
抗淀粉样蛋白免疫疗法已经在多个后期临床试验中进行了测试,治疗后的患者在可溶性生物标志物、淀粉样蛋白病理和认知功能方面表现出显著改善,使其成为最先进的疾病改善治疗选择[1,2]。一般的假设是,抗淀粉样蛋白-β (Aβ)抗体的剂量将驱动中枢神经系统(CNS)的免疫反应,通过促进淀粉样蛋白的清除和去除来中和聚集的Aβ。在一些临床试验中观察到,对这些免疫疗法的热情经常受到常见的,有时是严重的不良事件,淀粉样蛋白相关成像异常(ARIA)的阻碍[3,4,5]。多项证据表明,ARIA与血管淀粉样蛋白沉积有关,也被称为脑淀粉样血管病(CAA),表明CAA是与治疗相关的ARIA相关的关键神经病理成分[6]。然而,淀粉样蛋白免疫疗法如何增强caa介导的血管通透性和微出血的机制目前尚不清楚。
居住在脑实质的小胶质细胞在神经退行性变中已被广泛研究,而居住在血管周围和小脑膜间隙的脑膜、脑实质边界和循环免疫细胞在很大程度上未被研究。最近的研究已经确定了位于特定解剖位置的几种不同的免疫细胞亚群,它们在正常和病理条件下参与广泛的过程[7,8]。在中枢神经系统正常血管发育过程中,血管周围巨噬细胞直接与发育中的血管相互作用,影响血管生成过程的各个阶段,促进血管的发芽[9]、分支[10]和吻合[11]。此外,血管周围巨噬细胞已被证明可以预防细菌性脑膜炎[12],并有助于清除AD小鼠模型中的血管Aβ沉积[13,14,15,16]。然而,它们也可以介导Aβ肽诱导的氧化应激和脑血管功能障碍[17]。重要的是,接受a β免疫治疗的患者的神经病理学结果表明,血管周围巨噬细胞参与了脑血管内的a β吞噬和清除,强调了它们在宿主对a β免疫治疗的反应中的作用[18]。虽然血管周围巨噬细胞在ARIA诱导中的确切作用尚不清楚,但无论免疫治疗是主动的[19]还是被动的[20,21,22,23],都可以在脑血管周围腔室中观察到微出血的发生,这表明血管周围巨噬细胞可能参与对血管淀粉样蛋白靶向抗体形成的免疫复合物的反应。因此,利用成熟的a β免疫治疗诱导的小鼠微出血模型,我们旨在确定与caa介导的血管通透性、血浆蛋白外渗和出血消退相关的免疫细胞群。
本研究结果表明,AD小鼠的Aβ免疫治疗强烈诱导血管周围巨噬细胞的激活及其与CAA抗体免疫复合物的共定位。此外,我们在体外培养的巨噬细胞被抗体介导的Fc受体信号激活后,炎症信号和细胞外基质基因Timp1和MMP9的表达显著增加,并在体内证实了这些关键发现。最后,我们证明炎症单核细胞在血管淀粉样蛋白沉积周围高度丰富,并且与Aβ免疫治疗诱导的脑微出血的含铁血黄素沉积有关。
结果
Aβ免疫疗法激发CD169+血管周围巨噬细胞与血管淀粉样蛋白沉积的关系
It has been well established that anti-Aβ immunotherapy using Bapineuzumab and the murine monoclonal antibody equivalent 3D6 reduces total Aβ levels however, its administration also elicits notable inflammatory response, intensifies vascular permeability, compromises vascular integrity, and triggers the occurrences of microhemorrhages or ARIA in mouse models and AD patients [24,25,26]. PDAPP mice exhibit distinctive features of vascular amyloid deposition, primarily concentrated within the leptomeninges, but also penetrating vessels of the brain and display significant microhemorrhages in response to anti-Aβ (3D6) immunotherapy [26]. Therefore, we aimed to determine anti-Aβ immunotherapy mediated immune cell interactions around the sites of vascular amyloid accumulation, plasma protein extravasation, and microhemorrhages in 23-month old PDAPP animals. To validate the efficacy of Aβ immunotherapy in reducing Aβ immunoreactivity, PDAPP mice were subjected to a three-month treatment with either 3D6 or IgG control antibody. Subsequent staining of coronal sections confirmed a reduction in 3D6 immunoreactivity, encompassing both parenchymal and vascular Aβ deposits (Supplemental Fig. 1, a-d). To detect hemorrhagic events, sections were stained with Perl’s Prussian blue dye. Our findings revealed a significant increase in the Prussian blue+ area, indicating a higher incidence of hemorrhages and an enlargement of leptomeningeal vessel diameter in mice treated with 3D6 compared to the control IgG group (Fig. 1, a-c). These observations align with the documented increase in ARIA following Aβ immunotherapy observed in clinical trials [24, 25]. Considering the appreciable variability in CAA among PDAPP mice and our previous findings demonstrating 3D6-induced exacerbation of microhemorrhage can occur even without plaque reduction [26], a subset of 6 animals from the total microhemorrhage groups were blindly selected for further investigations and subgroup analysis. To determine immune cell interactions following Aβ immunotherapy, we evaluated microglia and macrophages associations with vascular amyloid deposits. We performed triple staining with Thio-S, PECAM-1, and P2Y12 to determine microglia association with vascular amyloid accumulation in the leptomeninges. Interestingly, we found no significant differences in P2Y12+ area or colocalization ratio relative to control IgG (Fig. 2, a-c). The absence of microglia associated with vascular amyloid was confirmed in penetrating vessels of the cortex with no significant differences in P2Y12+ area or colocalization ratio relative to control IgG (Supplemental Fig. 2, a-c), supporting previous reports [27, 28]. Additionally, Clec7a a well-known marker for plaque-associated microglia confirms reactive microglia are exclusively associated with parenchymal amyloid plaques not vascular amyloid deposits (Supplemental Fig. 3, a-b). To determine macrophages’ association to vascular amyloid accumulation, we performed triple staining with Thio-S, PECAM-1, and Mac387, an intracytoplasmic antigen found in macrophages but not in microglia [29,30,31]. Our results show macrophages are highly associated with vascular amyloid in 3D6 treated PDAPP mice with significant increases in Mac387+ area and colocalization ratio relative to control IgG (Fig. 2, d-f). To confirm these results, we evaluated macrophages’ association with vascular amyloid deposits in penetrating vessels of the cortex and observed significant increases in Mac387+ area and colocalization ratio relative to control IgG (Supplemental Fig. 2, d-f). Next, we sought to determine the subpopulation of macrophages associated to vascular amyloid deposits after Aβ immunotherapy. Previously, a subpopulation of perivascular macrophages has been identified that express CD169 (Sialic acid-binding immunoglobulin-type lectins-1, Siglec1) molecules on their surface and exhibit a unique anatomical location and functional phenotype in secondary lymphoid organs at the interface between circulating fluids where blood and lymph enter and leave [32]. Surprisingly, triple staining with Thio-S, PECAM-1, and CD169 revealed that CD169+ perivascular macrophages are highly associated with vascular amyloid in 3D6 treated PDAPP mice, with significant increases in CD169+ area and colocalization ratio compared to control IgG (Fig. 2, g-i). To confirm these results, we evaluated CD169+ perivascular macrophages’ association with vascular amyloid deposits in penetrating vessels of the cortex and observed significant increases in CD169+ area and colocalization ratio relative to control IgG (Supplemental Fig. 2, g-i). Notably, significant increases in CD169+ area were only observed with vascular amyloid+ vessels in 3D6 treated PDAPP suggesting the potential engagement of perivascular macrophage with vascular amyloid immune complexes (Supplemental Fig. 4, a-d). To further investigate the association of perivascular macrophages with vascular amyloid immune complexes, we employed an additional mouse model of Alzheimer’s Disease. Specifically, 24-month-old hTau APP KI mice were treated with biotinylated-3D6 or IgG for a duration of 1 month, followed by four-color immunofluorescence staining with X-34, streptavidin, CD169, and laminin—a marker for basement membranes. Our results confirm 3D6-Aβ immunotherapy promotes the formation of an antibody immune complex with vascular amyloid and is associated with CD169+ perivascular macrophages in the leptomeninges and penetrating vessels of the cortex in hTau APP KI mice (Fig. 3, a-d and Movies 1–4). Furthermore, we performed triple immunofluorescence staining with X-34, CD206 and CD163 both widely accepted markers for perivascular macrophages but not microglia [33], demonstrating their association with vascular amyloid after 3D6-Aβ immunotherapy (Supplemental Fig. 5). These findings indicate 3D6-Aβ immunotherapy results in increased occurrences of microhemorrhages, altered cerebrovascular structure and the formation of an antibody immune complex with vascular amyloid deposits associated with perivascular macrophage in the leptomeninges and penetrating vessels of the cortex in mouse models of AD.
3D6处理诱导PDAPP小鼠微出血。(a)普鲁士蓝(含铁血黄素,蓝色)标记的IgG或3D6处理的PDAPP小鼠脑轻脑膜和穿透血管微出血。(b) IgG或3d6处理小鼠脑冠状切片普鲁士蓝+面积(%)定量。(c) IgG或3D6处理小鼠脑轻脑膜直径测量(虚线)。定量时采用冠状总切片,每个数据点表示一只动物n = 20-25(小鼠)。均为26月龄PDAPP小鼠的代表性图像。结果以±SEM表示,星号表示有显著差异,其中**p < 0.01, ***p < 0.001,采用unpaired Student 's t检验。比例尺40 μm
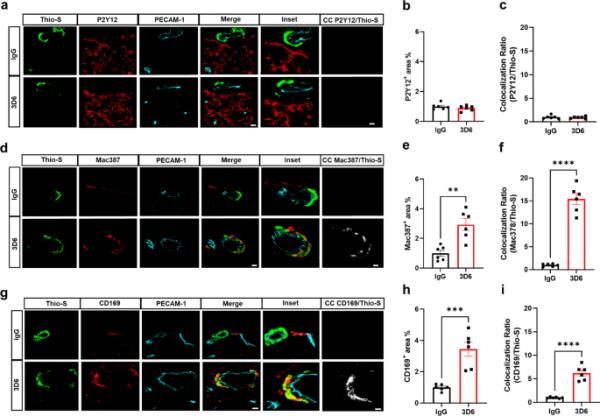
3D6处理的PDAPP小鼠血管周围巨噬细胞与血管淀粉样蛋白高度相关。(a) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、小胶质细胞(P2Y12,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, P2Y12和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(b) IgG或3D6处理小鼠P2Y12+面积(%)定量。(c)硫代硫代与P2Y12共定位比的定量。(d) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、巨噬细胞(Mac387,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, Mac387和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(e) IgG或3D6处理小鼠的Mac387+面积(%)定量。(f)定量Thio-S与Mac387共定位比。(g) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、血管周围巨噬细胞(CD169,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, CD169和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(h) IgG或3D6处理小鼠CD169+面积(%)定量。(i)硫代硫代与CD169共定位比的定量分析。分析的血管淀粉样蛋白沉积数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示差异显著,其中**p < 0.01, ***p < 0.001或****p < 0.0001。比例尺分别为5 μm CC和10 μm merge
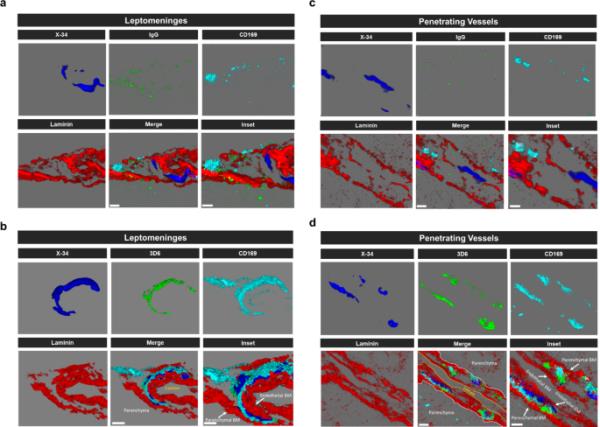
CD169+血管周围巨噬细胞与血管淀粉样免疫复合物在3D6治疗hTau APP KI小鼠中的作用。(a-d)生物素化3D6或IgG对照hTau APP KI小鼠淀粉样蛋白(X-34,蓝色)、抗体(IgG或3D6,绿色)、层粘连蛋白(红色)和血管周围巨噬细胞(CD169,青色)的四色免疫荧光。X-34,抗体,层粘连蛋白和CD169免疫反应性覆盖层(合并)。比例尺:合并3 μm,插入2 μm
被抗体介导的fc受体信号激活的巨噬细胞富含炎症和细胞外基质重塑基因
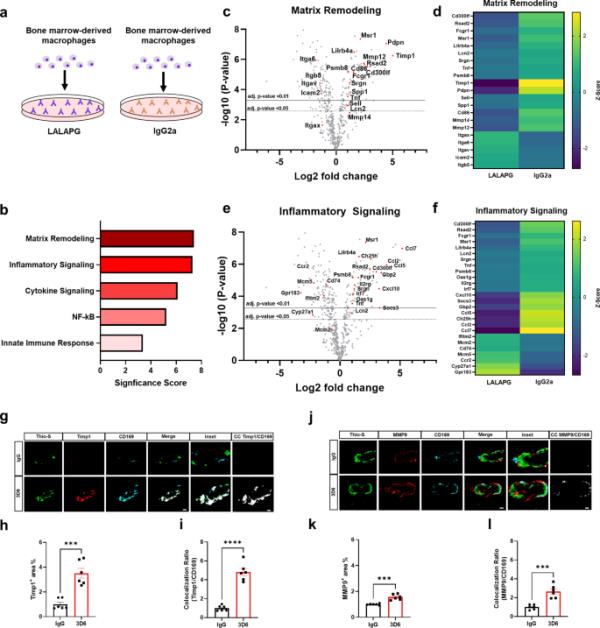
鉴于Aβ免疫治疗后CD169+血管周围巨噬细胞与血管淀粉样蛋白沉积的关联,我们想知道抗体-免疫细胞相互作用是否会产生独特的巨噬细胞基因表达谱。为了研究巨噬细胞免疫激活的更广泛机制,我们利用原代骨髓源性巨噬细胞(primary bone marrow-derived macrophages, BMDM)作为一种成熟且常用的体外模型来研究活化巨噬细胞的极化[34]。为了研究Fc受体激活的影响,我们在包被高Fc受体激活抗体IgG2a或含有LALAPG突变的同型对照抗体的孔中培养和镀BMDM,该抗体选择性地消除Fc- fcr介导的效应功能,同时保持抗体亲和力[35](图4a)。接下来,我们使用NanoString Technologies的神经炎症面板进行部分转录组分析,评估770个基因的表达,使我们能够进行基因集富集分析(GSEA)。GSEA显示,Fc受体信号激活的BMDM具有丰富的细胞外基质重塑和炎症信号通路的基因集和途径(图4b,补充数据1)。重要的是,定向差异表达基因的火山图和热图显示,基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)对应的基质重塑基因差异表达最显著。表明组织重塑和稳态失调(图4、c和d,补充数据2)。此外,定向差异表达基因的火山图和热图显示,CCL7、CCL5和CCL2对应的炎症信号基因差异表达最显著,表明趋化性和炎症反应失调(图4、e和f,补充数据2)。Timp1和Msr1随后通过qPCR验证,证实它们在炎症和细胞外基质重塑途径中富集(补充图6,a-c)。为了验证LALAPG同位素控制抗体能够阻断Fc受体信号,我们在涂有LALPG或未经处理的BMDM的孔中培养和镀初级BMDM。定向差异表达基因的火山图验证了没有基因符合调整p值截断< 0.05的标准,不存在显著差异表达(Supplementary Fig. 7, Supplementary Data 2)。

Aβ免疫疗法激活的血管周围巨噬细胞富含炎症和细胞外基质重塑基因。(a) IgG2a或LALAPG免疫缺陷对照抗体激活的巨噬细胞示意图。(b)活化IgG2a的巨噬细胞与对照LALAPG的NanoString基因集富集分析显著性评分。(c)火山图显示IgG2a激活的巨噬细胞与对照LALAPG激活的巨噬细胞中定向表达的基质重塑基因的差异。(d) NanoString生成的基质重塑基因表达热图(黄色=上调,紫色=下调)。(e)火山图显示IgG2a激活的巨噬细胞与对照LALAPG激活的巨噬细胞中直接表达的炎症信号基因差异。(f) NanoString生成炎症信号基因表达热图(黄色=上调,紫色=下调)。(g) 3D6或IgG对照处理的PDAPP小鼠中淀粉样蛋白(Thio-S,绿色)、Timp1(红色)和血管周围巨噬细胞(CD169,青色)的三重免疫荧光。Thio-S, Timp1和CD169免疫反应性覆盖(合并)。共定位分析(白色)。(h) IgG或3D6处理小鼠Timp1+面积(%)定量。(i) Timp1与CD169共定位比的量化。(j) 3D6或IgG对照处理的PDAPP小鼠中淀粉样蛋白(Thio-S,绿色)、MMP9(红色)和血管周围巨噬细胞(CD169,青色)的三重免疫荧光。Thio-S, MMP9和CD169免疫反应性覆盖(合并)。共定位分析(白色)。(k) IgG或3D6处理小鼠MMP9+面积(%)定量。(l) MMP9与CD169共定位比的定量。分析的血管淀粉样蛋白沉积数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示差异显著,其中***p < 0.001, ****p < 0.0001。横线值对应于j. p-value < 0.01(实线),j. p-value < 0.05(虚线)。比例尺分别为5 μm CC和10 μm merge
通过对Fc受体信号激活的BMDM中上调基因的NanoString分析,我们发现Timp1是一个特别感兴趣的细胞外基质基因,已知其在抑制MMPs、调节血脑屏障完整性和独立于金属蛋白酶的生物活性中具有直接或间接影响伤口愈合和炎症的作用[36]。为了确定Timp1是否可以作为a β免疫治疗后与血管淀粉样蛋白相关的CD169+血管周围巨噬细胞的分子标记,我们使用Thio-S、CD169和Timp1进行了三重染色。值得注意的是,我们的结果显示,相对于对照IgG, Timp1+的面积和与CD169+血管周围巨噬细胞的共定位比例显著增加(图4,g-i)。为了证实这些结果,我们评估了皮层的穿透血管,观察到Timp1+面积和与CD169+血管周围巨噬细胞的共定位比相对于对照IgG显著增加(补充图8,a-c),支持我们的NanoString结果(图4,c和d, GEO: GSE222466)。值得注意的是,在星形胶质细胞、小胶质细胞或内皮细胞中未检测到Timp1+的免疫反应性,这证实了Timp1+与活化的血管周围巨噬细胞的关联(补充图9,a-b)。有趣的是,Timp1是一种mmp9特异性组织抑制剂,可以结合前MMP-9和成熟的MMP-9, Timp1的升高被认为是缺血性损伤的保护性反应,以对抗MMP-9水平的升高[37,38]。为了确定CD169+血管周围巨噬细胞是否也是MMP9+,我们用Thio-S、CD169和MMP9进行了三重染色,观察到相对于对照IgG, MMP9+的面积和与CD169+血管周围巨噬细胞的共定位比例显著增加(图4,j- 1)。为了证实这些结果,我们评估了皮层的穿透血管,观察到相对于对照IgG, MMP9+的面积和与CD169+血管周围巨噬细胞的共定位比例显著增加(补充图8,d-f)。
众所周知,抗a β免疫治疗可诱导MMPs的激活,而MMPs可能会对脑血管基底膜和紧密连接蛋白进行蛋白水解,从而损害血管完整性,导致屏障渗漏和外渗[39,40]。为了确定血脑屏障(BBB)渗漏和血浆蛋白外渗,我们用硫硫、PECAM-1和纤维蛋白原(一种脑内不存在的凝血蛋白)进行了三重染色,除非存在脑血管血脑屏障或渗透性屏障的破坏[41,42,43]。我们的研究结果显示,与对照IgG相比,3D6处理的PDAPP小鼠血管淀粉样蛋白沉积物周围的纤维蛋白原增加,轻脑膜和皮层穿透性血管的纤维蛋白原+区域显著增加(补充图10,a-d)。这些观察结果表明,Aβ免疫治疗与Timp1+和MMP9+血管周围巨噬细胞的诱导、基底膜重塑以及与血管淀粉样蛋白沉积相关的纤维蛋白原外渗增加有关。然而,需要进一步的研究来确定脑血管靶向淀粉样蛋白免疫治疗在多大程度上增强MMP9/Timp1比值,影响血脑屏障通透性、血浆蛋白渗漏和外渗。
炎症莫在血管淀粉样蛋白沉积物周围有大量的nocytes,并且与Aβ免疫治疗诱导的微出血有关
为了进一步表征Aβ免疫治疗后血管淀粉样蛋白沉积周围的免疫细胞微环境,我们使用数据库进行注释、可视化和综合发现(DAVID),以确定抗体介导的Fc受体信号激活的BMDM中最显著上调的基因本体(GO)术语通路。氧化石墨烯富集分析显示,通过Fc受体信号激活的BMDM具有高度富集炎症反应和白细胞(包括中性粒细胞、嗜酸性粒细胞、淋巴细胞和单核细胞)的细胞趋化性相关基因的氧化石墨烯生物学过程(Supplementary Fig. 11a, Supplementary Data 3)。众所周知,以高表达Ly-6 C (Gr-1)和CC趋化因子受体2 (CCR2)为特征的促炎单核细胞,在各种情况下被招募到炎症部位,主要依赖于CCR2[44,45]。重要的是,与CCR趋化因子受体结合相对应的氧化石墨烯分子功能总体上是最高度富集的(补充图11b,补充数据3)。为了确定浸润性免疫细胞的存在,我们使用Thio-S、PECAM-1和GR-1进行了三重染色,以确定白细胞与瘦脑膜中血管淀粉样蛋白积累的关系。我们观察到3d6处理的PDAPP小鼠血管淀粉样蛋白周围白细胞高度丰富,相对于对照IgG, GR-1+区域和GR-1+细胞显著增加(图5,a-c)。为了进一步证实白细胞是单核细胞,我们用Thio-S、PECAM-1和CCR2进行了三重染色,CCR2是调节单核细胞向大脑浸润的特异性标记物[46]。我们的结果证实,3d6处理的PDAPP小鼠血管淀粉样蛋白周围单核细胞高度丰富,相对于对照IgG, CCR2+区域和CCR2+细胞显著增加(图5,d-f)。最近的证据表明,单核细胞在脑出血后具有双重作用,首先有助于炎症导致继发性损伤,另一方面,有助于修复血管周围间隙的血管出血,促进恢复[47,48,49]。为了确定免疫细胞与微出血的关系,我们用硫代硫代普鲁士蓝染料进行了三重染色,分别鉴定了表明先前出血的含铁血黄素沉积和小胶质细胞、巨噬细胞和单核细胞(图5)。我们的结果显示2%的含铁血黄素沉积对P2Y12+染色有免疫反应,8%的含铁血黄素沉积对Mac387+染色有免疫反应。值得注意的是,我们观察到浸润的单核细胞与PDAPP小鼠中的含铁血黄素沉积高度相关,其中37%的含铁血黄素沉积对Gr-1+染色具有免疫反应,39%的含铁血黄素沉积对CCR2+染色具有免疫反应(图5小时)。这些观察结果表明,3d6 - a - β免疫治疗诱导PDAPP小鼠微出血,血管淀粉样蛋白沉积物周围浸润单核细胞丰度增加,并与血管出血中的含铁血黄素沉积相关。
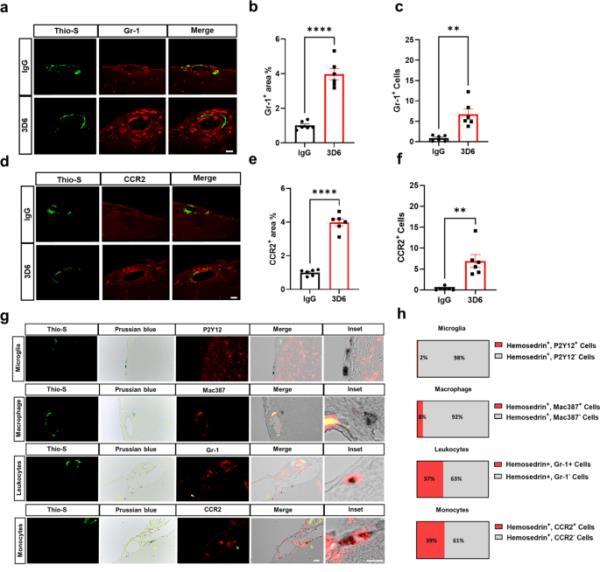
炎性单核细胞在血管淀粉样蛋白沉积物周围高度丰富,并与3D6治疗的PDAPP小鼠的微出血有关。(a) 3D6或IgG对照处理的PDAPP小鼠中淀粉样蛋白(硫代硫s,绿色)和白细胞(GR-1,红色)的双免疫荧光。硫代s和GR-1(红色)免疫反应性覆盖(合并)。(b) IgG或3D6处理小鼠GR-1+面积(%)定量。(c) IgG或3D6处理小鼠血管淀粉样蛋白沉积物周围GR-1+细胞的定量。(d) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(硫代硫s,绿色)和单核细胞(CCR2,红色)的双免疫荧光。Thio-S和CCR2(红色)免疫反应性覆盖(合并)。(e) IgG或3D6处理小鼠CCR2+面积(%)定量。(f) IgG或3D6处理小鼠血管淀粉样蛋白沉积物周围CCR2+细胞的定量,分析的血管淀粉样蛋白沉积物数量为每只动物8-10个。(g)淀粉样蛋白(Thio-S,绿色)、普鲁士蓝(含铁血黄素,蓝色)和免疫细胞(小胶质细胞、巨噬细胞和单核细胞,红色)的三重标记显示3D6治疗后caa相关微出血附近有含铁血黄素的单核细胞。(h) 3D6处理的PDAPP小鼠含铁血黄素+免疫细胞比例的定量。定量时,每次实验用8 ~ 17张图像n = 6(小鼠),计数140 ~ 200个细胞。星号表示差异显著,其中**p < 0.01, ****p < 0.0001。均为26月龄PDAPP小鼠的代表性图像。比例尺分别为10 μm inset或20 μm merge
目录
摘要介绍
结果
讨论
结论
方法
数据可用性
缩写
参考文献
致谢
作者信息
道德声明
电 nic补充资料
搜索
导航
#####
讨论
在本研究中,我们发现血管周围巨噬细胞可以被血管淀粉样蛋白沉积物富集的抗a β抗体激活。具体来说,3d6 - a - β免疫疗法促进血管淀粉样蛋白沉积的免疫复合物的形成。这些复合物随后激活CD169+血管周围巨噬细胞,并与PDAPP小鼠血浆蛋白外渗和微出血增加有关。此外,我们发现被抗体介导的Fc受体信号激活的培养BMDM富含炎症和细胞外基质重塑基因,并证实在体内存在MMP9和timp1阳性的血管周围巨噬细胞。最后,我们发现脑微出血的含铁血黄素沉积物被炎症单核细胞包围,炎症单核细胞在血管淀粉样蛋白沉积物周围非常常见。这些发现强调了血管周围巨噬细胞在CAA介导的血管通透性和与淀粉样蛋白免疫治疗相关的微出血中的重要参与,可能是通过局部炎症环境的放大和血管淀粉样蛋白沉积物周围细胞外环境的破坏重塑介导的。
In recent years, disease-modifying treatments for AD have primarily focused on the passive immunization of anti-Aβ antibodies to facilitate the clearance of plaques through the formation of antibody immune complexes which subsequently target amyloid for opsonization and phagocytosis. Bapineuzumab, aducanumab, donanemab and lecanemab were tested in late stage clinical trials with various degrees of efficacy for plaque removal and rescue of cognition decline. Bapineuzumab, a humanized form of murine monoclonal antibody 3D6, was the first antibody used for passive immunotherapy in late-stage clinical trials for AD, recognizing the linear N-terminus of Aβ and binding all forms of Aβ including prefibrillar aggregates and plaques [3]. Although effective in removing plaques, these antibodies have all resulted in ARIA, a serious risk and unintended adverse event manifesting in the human brain as edema (ARIA-E) or microhemorrhages (ARIA-H). Multiple theories have been postulated for the pathogenesis of treatment-related ARIA, as microhemorrhages have been shown to appear regardless of whether immunotherapy is active [19] or passive [20,21,22,23]. Nevertheless, accumulating evidence strongly suggests that the presence of vascular amyloid deposition, a primary component of CAA, is a critical factor for the development of ARIA [23]. In CAA, Aβ is deposited within vessel walls along perivascular drainage pathways in the brain, particularly between the endothelial and pial basement membranes (BMs), triggering profound changes in the perivascular space, including altered BM morphology, composition, thickness, and degeneration of smooth muscle cells noted in multiple studies of AD and CAA [50,51,52]. Data from human patients and in vivo models for CAA suggests that damage to vessel walls activates the endothelium, increases BBB permeability, facilitates the infiltration of monocytes/macrophages, and incites glial reactivity, increasing the production of pro-inflammatory cytokines [53, 54]. Recently, studies have suggested a multifaceted role for perivascular macrophages in the regulation of CAA, as the depletion of perivascular macrophages by directly injecting clodronate-containing liposomes in AD/CAA transgenic mouse models, results in a significant increase in CAA in cortical and leptomeningeal blood vessels [13, 55]. Whereas, the stimulation of perivascular macrophages by injecting chitin, a long-chain polymer of N-Acetylglucosamine, caused a significant reduction of Thio-S labeled cortical blood vessels and CAA load [13]. On the other hand, the sustained activation of perivascular macrophages has also been shown to accelerate neurovascular dysfunction as amyloid-mediated activation stimulates the release of reactive oxygen species, leading to increased cerebrovascular oxidative stress, ultimately suggesting perivascular macrophages as key immunoregulatory cells mediating vascular damage [17]. The utilization of single-cell analysis and fate-mapping techniques in transgenic animal models has greatly aided in the identification of distinct subsets of border-associated macrophages (BAMs). These subsets include subdural/leptomeningeal macrophages, dural macrophages, stromal choroid plexus macrophages, choroid epiplexus macrophages, and perivascular macrophages, each exhibiting unique characteristics in terms of morphology, motility, and function. Despite variations in transcriptional profiles and dynamics among BAMs, a comprehensive understanding of the functional diversity within these subsets in specific anatomical locations remains to be fully understood [56]. Notably, CD169+ perivascular macrophages are a unique subset of macrophages present in multiple tissues and organs throughout the body, primarily expressed in secondary lymphoid organs where blood and lymph enter and leave, ideally positioned to detect and respond to potentially harmful foreign agents and serve important roles in phagocytosis, antigen presentation, immune tolerance, and inflammatory responses [32]. These findings are supported by the results of our study, in which we report for the first time that CD169+ perivascular macrophages of the CNS are highly associated with vascular amyloid deposits following Aβ immunotherapy, forming an immune complex between basement membranes of leptomeningeal and penetrating vessels of the cortex and play important roles modulating local immune responses. To investigate the broader mechanisms of immune activation in macrophages, we utilized bone marrow-derived macrophages as a model to inference the transcriptional changes occurring in perivascular macrophages activated by Aβ immune complexes. We demonstrated that extracellular matrix remodeling genes were strongly enriched in BMDM activated through Fc receptor signaling, with the most significantly expressed genes corresponding to Timp1 and MMPs. Increased MMP/TIMP protein levels are frequently analyzed and interpreted in respect to the pathophysiology of disease and the net rise in MMP proteolytic activity. Although this interpretation is certainly valid and supports many aspects of disease pathology, such a perspective does not take into account the potential implications of TIMP activity as relevant for mechanisms of tissue injury or repair [57]. In AD patients, an interruption in the balance of MMPs and TIMPs has been studied in detail, as MMP9 is heavily implicated in the occurrence of cerebral hemorrhage due to immunotherapy [40]. Moreover, the MMP-9/Timp-1 ratio is independently associated with cerebral edema [58] and symptomatic intracerebral hemorrhage in ischemic stroke patients [59], indicating a critical role for the MMP9/Timp1 ratio in the regulation of BBB integrity. These findings are supported by the results of our study, in which we confirm the upregulation of MMP9 and Timp1 in perivascular macrophages associated with vascular amyloid deposits, strongly suggesting engagement of perivascular macrophages with vascular amyloid and anti-Aβ antibodies are associated with preponderant extracellular matrix remodeling and leakage of blood plasma proteins. These findings align with the recently clarified role of parenchymal border macrophages in regulating extracellular matrix remodeling in aging and neurodegeneration [60] however, further studies will be necessary to determine the extent to which perivascular macrophages activated by Aβ immunotherapy enhance the MMP9/Timp1 ratio in influencing ARIA.
此外,基因本体论分析还揭示了炎症和趋化信号是通过Fc受体信号激活的BMDM的顶级生物学过程和分子功能。在这种程度上,我们观察到Aβ免疫治疗与血管淀粉样蛋白沉积部位周围的Ly-6 C+ (Gr-1)和CC趋化因子受体2 (CCR2+)促炎单核细胞有关。最近的证据表明,单核细胞在脑出血后具有双重作用,最初会加重早期神经损伤,但也有助于修复血管周围间隙的血管出血,促进恢复[47,48,49]。此外,单核细胞向中枢神经系统的浸润是一个多步骤的过程,包括最初渗透内皮单层和基底膜,然后暂时停留在由内皮和实质基底膜包围的血管周围袖带,最后穿过实质基底膜和胶质细胞界限进入脑实质[61]。在这种程度上,我们观察到单核细胞与Aβ免疫治疗后PDAPP小鼠脑实质中的含铁血黄素沉积高度相关,37%的含铁血黄素沉积与Gr-1+细胞共定位,39%的含铁血黄素沉积与CCR2+细胞共定位。这一发现扩展了巨噬细胞仅与含铁血黄素沉积有关的传统观念。有趣的是,血管周围巨噬细胞产生的MMPs已被证明可以促进单核细胞浸润到脑实质,因为巨噬细胞来源的MMP2和MMP9活性对于白细胞渗透到脑实质至关重要[61]。这些关于血管周围巨噬细胞活性对脑血管功能障碍的时间影响的观察结果支持了我们关于纤维蛋白原短暂性血浆蛋白外渗和单核细胞向脑微出血募集的长期观察结果。因此,考虑到我们基于原代培养的结果显示,Fc受体信号激活的BMDM富含细胞外基质重塑基因,并且Aβ免疫治疗与抗体/淀粉样蛋白复合物相关的MMP9/ timp1阳性血管周围巨噬细胞相关,我们有理由认为,血管周围巨噬细胞与血管淀粉样蛋白的接触足以引发血管周围腔室的细胞外基质重塑。在Aβ免疫治疗期间,血管周围巨噬细胞参与组织重塑和血管功能障碍,与血管通透性改变和微出血有关。
尽管血管周围巨噬细胞活化与ARIA-E和ARIA-H之间关联的确切机制仍存在不确定性,但我们对这种关系的理解因研究ARIA-E的小鼠模型的有限可用性而进一步复杂化。然而,基于转基因小鼠的研究,提出了两种合理的假设来解释ARIA-H的临床表现,认为微出血可能归因于Aβ重新分布到脑血管[21],或者抗体直接结合到现有的CAA[20]。抗淀粉样蛋白免疫治疗所观察到的3D6免疫反应性降低提供了令人信服的证据,表明所观察到的变化确实与免疫复合物的形成有关,而不是a β从脑实质重新分布到脑血管系统。这一发现进一步强化了我们目前的研究结果,表明血管淀粉样蛋白抗体的直接结合和随后的血管周围巨噬细胞的激活在增强脑淀粉样蛋白血管病(CAA)介导的血管通透性和与淀粉样蛋白免疫治疗相关的微出血中起关键作用。这种效应是通过局部炎症环境的放大和血管淀粉样蛋白沉积物周围细胞外基质重塑的破坏介导的,这是非常可信的。
结论
总的来说,我们的研究结果支持这样的观点,即在CAA沉积物中富集的Aβ抗体导致血管周围巨噬细胞的募集和激活,增强血管通透性和对微出血的易感性。我们证实了被抗体介导的Fc受体信号激活的巨噬细胞富含炎症信号和细胞外基质重塑基因,并证实了在AD小鼠模型中存在Timp1+ CD169+和MMP9+ CD169+血管周围巨噬细胞与血管淀粉样蛋白沉积相关。最后,我们提供的证据表明,CD169+血管周围巨噬细胞可能增强caa介导的血管通透性、血浆蛋白外渗和与微出血相关的浸润性单核细胞。然而,我们承认在我们的研究中使用BMDM是有局限性的,因为BMDM是在含有血清的培养基中生长的,已知会影响基因表达和蛋白质水平的变化,因此使用BMDM只是提供了一个框架,以突出巨噬细胞中免疫激活的更广泛机制。为了更深入地研究这些差异,我们认识到,利用分离的和富集的血管周围巨噬细胞以及人类大脑样本,特别是从免疫治疗试验中收集的临床样本,进行进一步的转录组学分析将是必要的。通过这样做,我们可以全面细致地剖析这些差异,最重要的是,在Aβ免疫治疗过程中,我们可以确定血管周围巨噬细胞在人脑中的确切作用。
方法
转基因小鼠模型
实验采用PDAPP、hTau APP KI和野生型C57BL/6J (WT)雄性和雌性小鼠,包括细胞和免疫组织化学(IHC)分析。PDAPP菌落(13388系)是通过近交实验建立的,其中小鼠从选择的可溶性和不溶性Aβ保持较低变异性的窝中近交。自交系PDAPP 13388的斑块沉积表型与最初描述的PDAPP菌落相似[20]。APP KI小鼠的病理特征是可预测的斑块发展,实质淀粉样蛋白病理进行性增加,以及轻微但可检测到的脑淀粉样血管病[62]。PDAPP小鼠每周皮下注射3D6(抗a β1-x,IgG2b) (25 mg/kg)或每周两次皮下注射IgG (IgG2a同型)(50 mg/kg),持续3个月。hTau APP KI小鼠每周皮下注射生物肽- 3d6(抗a β1-x,IgG2b) (25 mg/kg)或每周皮下注射IgG (IgG2a同型)(25 mg/kg),持续一个月。给药实验采用23 ~ 26月龄。之所以选择这个年龄,是因为在PDAPP和hTau APP KI模型中,23-26月龄时血管淀粉样蛋白大量积累。所有实验均按照礼来公司的机构动物护理和使用指南进行。
脑切片免疫荧光
小鼠用阿维汀麻醉,并灌注冰PBS。将脑从颅骨中取出,在4% (wt/vol)多聚甲醛(PFA)中固定24小时,然后在30% (wt/vol)蔗糖的PBS溶液中冷冻保护。随后冷冻脑并使用冷冻/滑动切片机冠状切片(10 μm厚)。石蜡包埋冠状切片(10 μm厚)在二甲苯中脱烃,乙醇(EtOH)中再水合,去离子水洗涤。然后,切片在低pH 1x柠檬酸缓冲液中加热30分钟。在PBS中洗涤两次5分钟后,用5%山羊血清和0.01% Triton X-100的PBS溶液在室温(RT)下封闭1小时。切片在4°C下与以下抗体孵育过夜,每个抗体在阻断溶液中稀释1:100:抗p2y12 (as-55043a, AnaSpec)、抗mac387 (MA1-81381, ThermoFisher)、抗clec7a(内部生成)、抗cd206 (NC9751189, ThermoFisher)、抗cd169 (NB600-534, NovusBio)、抗cd169 (MA1-80164)、抗cd169 (PIPA5115898)、抗cd163 (50-198-4796, ThermoFisher)、抗laminin (NB300-144,NovusBio)、抗cd31 (PA5-16301, ThermoFisher)、抗timp1 (16644-1-ap, Proteintech)、抗gfap(13-030-0)、抗mmp9 (ab38898, Abcam)、抗纤维蛋白原(ab34269,抗gr -1 (14-5931-82, ThermoFisher)和抗ccr2 (MA5-41175, ThermoFisher)。第二天,切片在PBS中洗涤3次,用以下二抗孵育,室温下1小时,在阻断液中稀释1:100:山羊抗小鼠IgG 555 (A31570, ThermoFisher)、山羊抗小鼠IgG 647 (A32728, ThermoFisher)、山羊抗兔IgG 555 (A32732, ThermoFisher)、山羊抗兔IgG 647 (A32733, ThermoFisher)、山羊抗大鼠IgG 555 (A21434, ThermoFisher)、山羊抗大鼠IgG 647 (A48272, ThermoFisher)、链亲和素488 (S32354, ThermoFisher)。然后将载玻片与4% pfa交联5分钟,然后在去离子PBS中洗涤2次,每次5分钟。淀粉样蛋白用0.025% Thioflavin-S (Thio-S, Sigma-Aldrich, T1892)或X-34 (SML1954, 1:10 000)在50% EtOH中在TBS中染色,在RT下染色10分钟,然后在50% EtOH中洗涤2次5分钟,在PBS中洗涤2次5分钟。最后,切片在PBS中洗涤,并用不含DAPI (P36961, ThermoFisher)的extend Diamond Antifade培养基贴装。
免疫组织化学和显色染色
在2%亚铁氰化钾(EMS, 26613-01)和2%盐酸中孵育30分钟,然后在PBS中洗涤两次5分钟,对载玻片进行以含铁血黄素沉积为标志的血管出血染色。用于微出血分析的载玻片用核快红(N8002, Sigma-Aldrich)反染5分钟,然后在PBS中洗涤5分钟。淀粉样蛋白用3µg/ml生物素化3D6染色。使用生物素特异性HRP试剂,用DAB-Plus (DAKO)观察沉积的斑块。最后,切片在PBS中洗涤,并用不含DAPI (P36961, ThermoFisher)的extend Diamond Antifade培养基贴装。
骨髓源性巨噬细胞原代培养
用于BMDM培养的程序基于先前描述的方法[63]。简单地说,从8月龄的C57BL/6J小鼠中提取股骨和胫骨,浸泡在冰冷的RPMI培养基(22400-071)中,然后在70%的EtOH中浸泡10 s,立即用RPMI洗涤。为了排出骨髓,切开骨骺,用注射器和26号针头将5mL DPBS注入锥形管中。采集骨髓,通过70 μm细胞过滤器,用37℃预热的BMDM培养基(RPMI, 10%透析的FBS, 1 × Pen/Strep, 1 mM丙酮酸钠,1 × MEM NEAA, 1 × Glutamax)重悬。骨髓细胞计数后,在8mL BMDM培养基+ 50ng/mL小鼠巨噬细胞集落刺激因子(M-CSF, Peprotech, 315-02-50UG)中接种于10 cm培养皿中,4E6个/板。
骨髓源性巨噬细胞抗体接合
抗体包被板采用24孔板,包被200 uL的10ug/mL IgG2a, mIgG2a。LALAPG或未经处理(PBS载体),用旁膜密封,在4℃下孵育过夜。培养5天后(37℃,5% CO2),用PBS洗涤分化的BMDMs,用5mL 5mM EDTA分离,在37℃下分离5分钟,然后将BMDMs合并,在1500 rpm下RT离心5分钟。用PBS洗涤细胞,并在1500 rpm下RT旋转5分钟。将颗粒重悬于BMDM培养基中并计数。在包被的24孔板上,以40万个细胞/孔的速率,用1mL BMDM培养基+ 20ng/mL小鼠M-CSF接种BMDM。48 h后,用Qiagen Rneasy Plus Micro Kit(74034)分离RNA。
纳米串基因压力分析
从原代骨髓源性巨噬细胞中纯化总mRNA,并使用nCounter分析系统(NanoString Technologies, Seattle, WA, USA)结合nCounter小鼠神经炎症小组进行多路复用,该小组包括770个基因,涵盖了定义神经免疫相互作用和激活的核心途径。简单地说,每个样品(20 ng/µl) (n = 1)装载100 ng总RNA,并按照制造商的方案在65°C下与探针杂交16小时。靶基因计数归一化为最合适的内务基因,由nSolver软件确定,以解释RNA含量的变化。背景信号计算为负杂交控制探针的平均值。当表达数据低于阴性对照的平均背景信号时,将其排除在外,对于6个或更多样本,读数< 100的探针从分析中删除。使用Benjamini-Yekutelli方法计算错误发现率(FDR)[64],使用调整后的p值< 0.01来鉴定非定向差异表达的显著基因。下游分析和基因表达数据集的可视化使用ROSALIND分析平台(onRamp生物信息学)软件进行。GO和KEGG富集分析使用Database for Annotation, Visualization, and Integrated Discovery (DAVID)网站进行[65,66]。
qPCR
使用RNeasy Plus Micro Kit (Qiagen, 74034)从处理过的BMDM培养物(50,000个细胞,使用3个生物/ 3个技术重复)中分离总RNA。用Fluidigm Reverse Transcription Master Mix (Standard BioTools, 100-6298)从50ng总RNA中制备cDNA。cDNA用TaqMan PreAmp Master Mix (Applied Biosystems, 4391128)按照制造商推荐的方案进行预扩增。所有qpcr均在Biomark HD系统上使用48.48动态阵列基因表达IFC (Standard BioTools, BMK-M-48.48)进行。采用Taqman探针组(Actb: Mm02619580_g1, Msr1: Mm00446214_m1, Pdpn: Mm01348912_g1, Timp1: Mm01341361_m1;Applied Biosystems)和TaqMan通用PCR Master Mix (Applied Biosystems, 4326708)。
显微镜和图像分析
对于小鼠脑切片的图像分析,我们使用ImageJ软件v1.53 (NIH)创建一个指数,表示P2Y12+、Mac387 +、CD169 +、PECAM-1 +、Timp1 +、MMP9 +、Fibrinogen +、GR-1 +或CCR2 +像素的数量变化除以图像中的总像素数,表示为(+)area %。为了确保我们研究结果的代表性,我们在从总体中选择用于后续免疫组织学研究的动物时采用了随机选择。在微出血组中随机选择3D6和IgG处理的PDAPP小鼠亚组(每组6只),使用SP8共聚焦显微镜(徕卡),63倍物镜,0.15 μm z-step检查大脑皮层。我们分析了每只动物的细脑膜和穿透血管中的8-10个血管淀粉样蛋白沉积,每只小鼠使用两个脑切片。此外,我们通过测量从组织边缘边缘到脑脊膜表面的细脑膜直径,以微米为单位进行量化。结果显示为n = 6(小鼠)的±SEM。为了量化共定位,在Imaris v8.4 (Bitplane)中分析图像,使用Manders系数确定相对共定位系数(共定位比)[67]。全脑切片采用蔡司AxioScan Z.1, 20倍物镜(0.8NA)扫描。然后使用HALO v3.5图像分析套件(Indica Labs)分析沿组织边缘图像(100 μm宽)定义的感兴趣区域,并对含铁血黄素+信号进行阈值设置,以量化相对于ROI的染色覆盖率百分比。使用带40X物镜的Olympus BX63获取明场图像,使用ImageJ v1.53对细胞进行计数。
统计和可重复性
在结果和方法中分别给出了本研究中不同数据分析中使用的实验设计和统计的详细信息。样本量是根据以前的出版物确定的。纳米链实验采用4个技术重复,qPCR验证采用3个生物重复。对于本研究中使用的成像实验模式,至少使用了六个独立的生物重复,以确保稳健和可靠的结果。研究者在染色实验中采用盲法。采用GraphPad Prism 8.0.2进行统计分析。使用学生t检验(双尾)计算组间的统计学显著性。除非另有说明,数据以平均值±SEM表示。*, **, *** 和* * * *表示p < 0.05, p < 0.01, p < 0.001和p < < 0.0001,分别。除非另有说明,否则其他统计比较均无显著意义。
电nic补充资料
以下是电子补充材料的链接。
13024 _2023_649_moesm1_esm.docx
补充图1:抗淀粉样蛋白免疫治疗的PDAPP小鼠3D6免疫反应性降低。(a)经IgG或3D6处理的PDAPP小鼠冠状切片上的实质和血管淀粉样β沉积(棕色,3D6)。(b) IgG或3D6处理小鼠脑冠状切片3D6+面积(%)定量。(c) IgG或3D6处理小鼠脑冠状切片3D6+面积(%)的实质Aβ沉积定量。(d) IgG或3D6处理小鼠脑冠状切片3D6+区血管Aβ沉积定量(%)。每个数据点表示一个动物n = 20-25(小鼠)。均为26月龄PDAPP小鼠的代表性图像。结果以±SEM表示,星号表示有显著差异,其中**p < 0.01, *** p < 0.001,采用unpaired Student 's t检验。标尺分别为20 μm或500 μm。
13024 _2023_649_moesm2_esm.docx
补充图2:3D6处理的PDAPP小鼠血管周围巨噬细胞与穿透血管淀粉样蛋白高度相关。(a) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、小胶质细胞(P2Y12,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, P2Y12和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(b) IgG或3D6处理小鼠P2Y12+面积(%)定量。(c)硫代硫代与P2Y12共定位比的定量。(d) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、巨噬细胞(Mac387,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, Mac387和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(e) IgG或3D6处理小鼠的Mac387+面积(%)定量。(f)定量Thio-S与Mac387共定位比。(g) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(Thio-S,绿色)、血管周围巨噬细胞(CD169,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, CD169和PECAM-1免疫反应性覆盖(合并)。共定位分析(白色)。(h) IgG或3D6处理小鼠CD169+面积(%)定量。(i)硫代硫代与CD169共定位比的定量分析。分析的血管淀粉样蛋白沉积数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示差异显著,其中**p < 0.01, ****p < 0.0001。比例尺分别为5 μm CC和10 μm merge。
13024 _2023_649_moesm3_esm.docx
补充图3:Clec7a+小胶质细胞与血管淀粉样蛋白无关。(a) 3D6或IgG对照处理的PDAPP小鼠脑轻脑膜中淀粉样蛋白(Thio-S,绿色)和活化的小胶质细胞(Clec7a,红色)的双重免疫荧光。硫代s和Clec7a免疫反应性覆盖(合并)。(b) 3D6或IgG对照处理的PDAPP小鼠穿透血管中淀粉样蛋白(Thio-S,绿色)和活化的小胶质细胞(Clec7a,红色)的双重免疫荧光。硫代s和Clec7a免疫反应性覆盖(合并)。比例尺10 μm。
13024 _2023_649_moesm4_esm.docx
图4:3D6处理的PDAPP小鼠血管周围巨噬细胞只富集淀粉样蛋白+血管。(a)经IgG对照处理的PDAPP小鼠淀粉样蛋白+ (Thio-S,绿色)或淀粉样蛋白-血管、血管周围巨噬细胞(CD169,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, CD169和PECAM-1免疫反应性覆盖(合并)。(b)定量淀粉样蛋白+或淀粉样蛋白-血管中IgG的CD169+面积(%)。(c) 3D6处理的PDAPP小鼠淀粉样蛋白+(硫代s,绿色)或淀粉样蛋白-血管、血管周围巨噬细胞(CD169,红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。Thio-S, CD169和PECAM-1免疫反应性覆盖(合并)。(d)淀粉样蛋白+或淀粉样蛋白-血管中3D6 CD169+面积(%)的定量。分析的血管数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示有显著性差异,其中***p < 0.001通过未配对学生t检验。比例尺分别为10 μm merge和5 μm inset。
13024 _2023_649_moesm5_esm.docx
补充图5与血管淀粉样蛋白相关的血管周围巨噬细胞CD206和CD163阳性。3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(X-34,蓝色)、血管周围巨噬细胞(CD206,红色)(CD163,绿色)的三重免疫荧光。X-34, CD206和CD163免疫反应性覆盖(合并)。比例尺5 μm。
13024 _2023_649_moesm6_esm.docx
补充图6 qPCR证实了炎症信号和细胞外基质重塑基因的失调。(a) IgG2a激活的BMDM与对照LALAPG中Pdpn的相对表达量(b) IgG2a激活的BMDM与对照LALAPG中Timp1的相对表达量(c) IgG2a激活的BMDM与对照LALAPG中Msr1的相对表达量。数据归一化为肌动蛋白mRNA水平。采用2−ΔΔCt (fold change)法进行相对定量。结果显示为n = 3(独立培养)的平均值±SEM。星号表示差异显著,其中* p < 0.05, ** p < 0.01。
13024 _2023_649_moesm7_esm.docx
补充图7:经LALAPG处理的骨髓源性巨噬细胞与未处理组相比,基因表达无显著差异。(a)免疫缺陷LALAPG控制抗体处理巨噬细胞示意图。(b)火山图显示LALAPG激活的巨噬细胞与对照未处理的巨噬细胞中基因表达无显著差异。水平线值对应于p值< 0.01(实线),p值< 0.05(虚线)。
13024 _2023_649_moesm8_esm.docx
补充图8:Aβ免疫疗法激活的穿透血管的血管周围巨噬细胞表达细胞外基质重塑基因。(a) 3D6或IgG对照处理的PDAPP小鼠中淀粉样蛋白(Thio-S,绿色)、Timp1(红色)和血管周围巨噬细胞(CD169,青色)的三重免疫荧光。Thio-S, Timp1和CD169免疫反应性覆盖(合并)。共定位分析(白色)。(b) IgG或3D6处理小鼠Timp1+面积(%)定量。(c) Timp1与CD169共定位比的量化。(d) 3D6或IgG对照处理的PDAPP小鼠中淀粉样蛋白(Thio-S,绿色)、MMP9(红色)和血管周围巨噬细胞(CD169,青色)的三重免疫荧光。Thio-S, MMP9和CD169免疫反应性覆盖(合并)。共定位分析(白色)。(e) IgG或3D6处理小鼠MMP9+面积(%)定量。(f) MMP9与CD169共定位比的定量。分析的血管淀粉样蛋白沉积数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示差异显著,其中*p < 0.05, ***p < 0.001。比例尺分别为5 μm CC和10 μm merge。
13024 _2023_649_moesm9_esm.docx
在星形胶质细胞、小胶质细胞或内皮细胞中未检测到Timp1+免疫反应性。(a) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(X-34,蓝色)、星形胶质细胞(GFAP,绿色)、Timp1(红色)和内皮细胞(PECAM-1)的四色免疫荧光。(b) 3D6或IgG对照处理的PDAPP小鼠淀粉样蛋白(X-34,蓝色)、小胶质细胞(Clec7a,绿色)、Timp1(红色)和内皮细胞(PECAM-1)的四色免疫荧光。免疫反应性覆盖(合并)。比例尺10 μm。
13024 _2023_649_moesm10_esm.docx
图10 3D6处理的PDAPP小鼠血管淀粉样蛋白沉积物周围纤维蛋白原增加。(a) 3D6或IgG对照处理的PDAPP小鼠瘦脑膜中淀粉样蛋白(硫代硫s,绿色)、纤维蛋白原(红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。硫硫,纤维蛋白原和内皮细胞(PECAM-1,青色)免疫反应性覆盖(合并)。(b) IgG或3D6处理小鼠纤维蛋白原+面积(%)定量。(c) 3D6或IgG对照处理的PDAPP小鼠穿血管淀粉样蛋白(绿色)、纤维蛋白原(红色)和内皮细胞(PECAM-1,青色)的三重免疫荧光。硫硫,纤维蛋白原和PECAM-1免疫反应覆盖(合并)。(d) IgG或3D6处理小鼠纤维蛋白原+面积(%)定量。分析的血管淀粉样蛋白沉积数量为每只动物8-10个。结果显示为n = 6(小鼠)的±SEM。星号表示差异显著,其中**p < 0.01, ***p < 0.001。比例尺分别为5 μm merge和10 μm inset。
13024 _2023_649_moesm11_esm.docx
被Fc受体信号激活的巨噬细胞具有丰富的趋化信号的生物学过程和分子功能。(a,b) Fc受体信号激活的骨髓源性巨噬细胞中差异表达基因的DAVID生物信息学基因本体富集分析。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13024-023-00649-w.pdf