摘要
背景
非介入性PROPER研究为免疫介导性炎症患者从参考阿达木单抗转为ema批准的SB5生物仿制药阿达木单抗的常规实践后的临床结果提供了真实证据。
方法
类风湿性关节炎(RA)、轴性脊柱性关节炎(axSpA)、银屑病关节炎(PsA)、克罗恩病(CD)或溃疡性结肠炎(UC)的成年人在欧洲63个地点入选。符合条件的患者在过渡到SB5之前接受了≥16周的参考阿达木单抗常规治疗,并在过渡后随访48周。主要目的是评估在开始治疗后48周与SB5持续治疗相关的候选预测因子(根据适应症队列,发病率≥15%的临床相关基线变量)。关键的主要结局指标是SB5治疗的持续性(通过Kaplan-Meier方法估计)以及过渡到SB5治疗时的临床特征和疾病活动性评分(基线)。
结果
共有955名符合条件的患者入组(RA, n = 207;axSpA, n = 127;PsA, n = 162;CD, n = 447;UC, n = 12),其中932例(97.6%)完成随访,722例(75.6%)在第48周仍在接受SB5治疗。对于RA、axSpA、PsA和CD, Kaplan-Meier估计(95%置信区间,CI)在第48周对SB5的持续治疗分别为0.86(0.80 - 0.90)、0.80(0.71-0.86)、0.81(0.74-0.86)和0.72(0.67-0.76)。与第48周前SB5停药概率相关的唯一候选预测因子是女性[RA、axSpA和CD队列];人力资源(95% CI): 3.53(1.07 - -11.67), 2.38(1.11 - -5.14),和2.21(1.54 - -3.18),分别)。在整个研究过程中,疾病活动性评分基本保持不变,基线时与第48周相比,队列缓解的比例分别为59.2%对57.2%,81.0%对78.0%,94.7%对93.7%,RA、axSpA、PsA和CD患者的84.0%对85.1%。同样,从基线到第48周,大多数患者的SB5给药方案保持不变,最常见的方案是每2周40mg。总共有232例患者(24.3%)报告了至少一次药物不良反应,大多数事件是轻微的;RA队列中有8名患者(3.9%)经历了9次严重不良事件(sae;两个可能与SB5有关);PsA队列中8名患者(4.9%)经历了9次SAEs(1例可能与SB5相关);在CD队列中,22名患者(4.9%)经历了27次SAEs(4例可能与SB5相关);UC队列中未观察到SAEs。
结论
除了RA、axSpA和CD中的女性外,所有候选预测因素均与SB5停药无关。SB5的持久性高,维持治疗效果,未检测到安全信号。
试验注册
该试验已在ClinicalTrials.gov注册:NCT04089514。
1 介绍
肿瘤坏死因子(Tumor necrosis factor, TNF)是一种参与类风湿关节炎(RA)、轴性脊柱炎(axSpA)、银屑病关节炎(PsA)、克罗恩病(CD)、溃疡性结肠炎(UC)等免疫介导炎性疾病(IMIDs)病理生理的细胞因子[1,2,3,4,5,6]。引入生物疾病改善抗风湿药物(DMARDs),如TNF抑制剂(如阿达木单抗、依那西普、英夫利昔单抗、戈利单抗、certolizumab)作为IMIDs患者的治疗选择已被证明是非常宝贵的,可以快速抑制炎症,延缓或预防疾病进展,维持缓解,改善患者的生活质量[7,8]。然而,在国家层面上,由于成本高,这些dmard的使用可能受到限制,在患者层面上,由于国家特定的报销标准或患者高额自付的要求,这些dmard的使用可能受到限制[9,10]。及时、适当的治疗可降低继发性IMIDs和心肌梗死的风险[11,12,13]。因此,未经治疗或治疗不充分的IMIDs可能会增加患者、医疗保健系统和社会经济层面的总体疾病负担[9,10]。生物仿制药作为参考产品的低成本替代品的发展可能会减轻这些限制[7]。与参考产品相比,生物仿制药潜在的更低成本可能会改善患者的可及性,从而减轻患者的疾病负担[9]。
SB5 (Imraldi™)已被开发为参考阿达木单抗(Humira®)的生物类似药[14,15],并且在I期和III期研究中显示出与参考阿达木单抗相同的疗效和相当的药代动力学,安全性和免疫原性[16,17]。SB5于2017年8月获得欧洲药品管理局(European Medicines Agency)批准,用于与参考药物阿达木单抗相同的适应症[18],并于2018年10月在欧洲上市处方[19]。从参考阿达木单抗过渡到SB5之前曾在一项随机对照试验中进行过评估,该试验在单一适应症(RA)中具有狭窄的资格标准[20];需要有代表性人群的长期真实证据[21]。
PROPER研究旨在为常规临床实践中从参考阿达木单抗转向SB5的结果提供真实证据,为医生、患者、卫生技术评估机构和其他利益相关者提供信息和支持决策。
2 方法
2.1 研究设计和患者
PROPER是一项非介入性、单队列、真实世界的研究,在六个欧洲国家(德国、西班牙、意大利、英国、比利时和爱尔兰)的专科诊所进行,采用伞式方法。为了同时实现和加速跨多个适应症的数据生成,设计了一个单一的协议,以便灵活实施,以捕获不同治疗领域和专业中实际使用SB5的数据[22]。在SB5开始时年龄≥18岁且诊断为RA、axSpA、PsA、CD或UC的患者被纳入研究。所有患者在2018年10月18日之后,在参考阿达木单抗治疗≥16周后,立即开始使用SB5作为常规管理的一部分。其他入选标准是基线时(SB5起始时间)至少有一项疾病活动评分评估,并提供知情同意参与。
数据采用SB5启动前24周的回顾性患者图表,以及此后的前瞻性和/或回顾性数据。预计大约每3个月进行一次诊所访问(取决于当地的护理标准)。无论在第48周之前是否继续使用SB5,在开始使用SB5后48周继续进行个体随访。
该方案、其修正案和患者知情同意书由负责任的伦理委员会批准。该研究按照赫尔辛基宣言[23]的伦理原则和所有适用的当地法规进行,并在ClinicalTrials.gov注册(NCT04089514)。
2.2 研究目的和结果测量
2.2.1 主要目标和结果测量
主要目的是评估诊断为IMIDs的患者持续使用SB5的候选预测因素,其中持续时间定义为从开始使用SB5停止的时间(以周为单位)。候选预测因子是基线临床特征(性别、相关病史、SB5起始年龄、疾病持续时间、疾病活动评分和相关伴随治疗)。疾病活动性评分是研究地点常规使用的评分:28个关节的疾病活动性评分使用c -反应蛋白(DAS28-CRP;转化的DAS28- crp (DAS28- crpconv)是通过红细胞沉降率(无法获得c反应蛋白[24])从DAS28中提取的,用于RA和PsA患者的一些德国位点;汉诺威(FFbH)对RA的功能;浴缸强直性脊柱炎疾病活动指数(BASDAI);银屑病关节炎反应标准(PsARC) PsA肿胀关节计数(66个关节)和压痛关节计数(68个关节);CD的哈维-布拉德肖指数(HBI)和UC的部分梅奥评分(PMS)[见电子补充材料(ESM)表S1]。
根据研究者的临床意见定义SB5开始时或之后以及SB5停药之前或停药时发生的疾病发作。记录每个适应症的诊断方法(通过评估疾病活动度评分、患者报告的症状或继发性反应丧失)和因发作而采取的措施。
2.2.2 瑞士边界目标和结果测量
次要目的是描述研究人群的基线临床特征、SB5的使用、生物药物有效性、患者对SB5给药装置的满意度以及相关伴随药物的使用,以及描述SB5的免疫原性和安全性。次要结局指标包括患者基线和疾病特征;在整个研究过程中,SB5的给药类型、剂量、方案和方法[预充笔(pen)或预充注射器(注射器)];适应症疾病活动度评分随时间变化(ESM表S1);患者满意度问卷(PSQ) (ESM表S2);患者报告的结果测量(PROMs) (ESM表S2);使用免疫抑制剂和/或使用皮质类固醇和/或生物疗法(SB5除外);抗阿达木单抗(ADAs);药物不良反应(adr)的发生率,定义为被认为与SB5有因果关系的非严重不良事件(ae);以及所有严重的ae (sae)。使用《监管活动医学词典》(23.0版)对所有ae进行编码[25],并对其进行评估,以确定是否符合SAE标准(ESM表S3)。
通过PSQ (ESM表S2)记录患者对SB5给药装置的满意度,患者在基线和常规就诊时完成PSQ(研究12周、24周和48周或研究结束时,以先发生者为准)。
从基线到第48周期间捕获的PROMs是健康评估问卷- RA、axSpA和PsA的残疾指数,Bath强直性脊柱炎的axSpA功能指数,以及炎症性肠病(IBD)-控制问卷8项亚评分和视觉模拟量表评分(ESM表S2)。
2.3 统计分析
2.3.1 样本量计算
样本量通过建立主要结局的基本临床预测模型(即评估SB5持续治疗的候选预测因子)来计算(ESM Section 1.3和表S4)[26]。所有分析均使用来自所有接受至少一剂SB5的合格患者的数据进行。
2.3.2 主要结局指标分析
对于主要结局测量,选择以下在基线时报告的临床相关变量(≥15%)作为候选预测因子:SB5开始时的年龄、性别、病史、伴随用药、疾病持续时间和疾病活动评分。通过单变量Cox回归分析评估这些候选预测因子对SB5持久性的影响(每个适应症单独评估)。计算每个候选预测因子的风险比(HR)和相应的95%置信区间(ci)。采用Kaplan-Meier方法,根据适应症和每个候选预测因子估计SB5停药的时间。
2.3.3 Seco分析终点测量
对次要结局指标进行描述性分析。连续变量报告为平均值、标准差、中位数、四分位数间距、95% CI、最小值和最大值。分类变量总结为频率和百分比。疾病活动性和PROM评分作为每个时间点的绝对值,并以从基线到第12、24和48周的配对值变化来表示。对于疾病活动度评分和prom的分析,访问窗口应用如下:基线,16周前至第一次给药SB5后6周;首剂SB5后第12周、7-18周;首次给药后第24周、19-36周;第一次给药后48周、37-60周。
对于PSQ,基线窗口为SB5起始至首剂SB5后6周。对于阿达木单抗ADAs的分析,基线定义为SB5首次给药前16周至2周,基线后定义为SB5首次给药后> 2周至60周。当捕获多个基线测量时,只有最接近SB5起始的测量被包括在分析中。如果在一个特定的时间点捕获多个后基线测量,则只有最坏情况的测量被包括在分析中。
所有统计分析均使用SAS 9.4或更高版本进行。
目录
摘要1 介绍
2 方法
3.结果
4 讨论
5 结论
参考文献
致谢
作者信息
道德声明
补充信息
相关的内容
搜索
导航
#####
3.结果
3.1 患者-人口统计学和临床特征
在63个地点的1033名患者中入组(德国,n = 19;西班牙,n = 14;意大利,n = 11;英国,n = 10;比利时,n = 8;在爱尔兰(n = 1), 955人符合资格标准:RA 207人,axSpA 127人,PsA 162人,CD 447人,UC 12人。其中932例(97.6%)完成了研究(ESM图S1)。
患者人口统计和基线疾病特征见表1。PsA组和CD组的男女性别分布平衡;axSpA和UC组以男性为主,RA组以女性为主。
从参考阿达木单抗过渡到SB5的主要原因因适应症而异,包括:卫生当局/付款人强制过渡、费用和医生决定。根据医生的意见,所有队列中的大多数患者在基线时病情稳定(n = 497, 53.1%)或缓解(n = 359, 38.4%)。疾病状态的分类取决于疾病活动评分或医生意见。
在RA队列中,根据DAS28-CRPconv(评分≤2.4),59.2%的患者在基线时处于缓解状态,医生认为分别有24.2%和67.6%的患者处于缓解状态和病情稳定(图1a)。在axSpA队列中,81.0%的患者在BASDAI基线时疾病活动性评分较低(< 4.0),21.2%和70.3%的患者在医生的意见下病情缓解和稳定(图1b)。当使用PsARC评估基线疾病状态时,94.7%的PsA患者为非活动性疾病(关节肿胀或压痛评分< 3,两种评分均可用);根据医生意见,分别有31.4%和61.7%的患者认为病情缓解,病情稳定(图1c)。在CD患者中,根据HBI, 84.0%的患者在基线时缓解(评分< 5);根据医生意见,52.9%的患者病情缓解,38.2%的患者病情稳定(图1d)。在UC队列中,58.4%的患者在PMS基线时缓解(评分< 2),根据医生意见,分别有25.0%和66.7%的患者被认为缓解和疾病稳定(图1e)。ESM表S5提供了从基线到第48周的绝对疾病活动性评分和prom的总结。
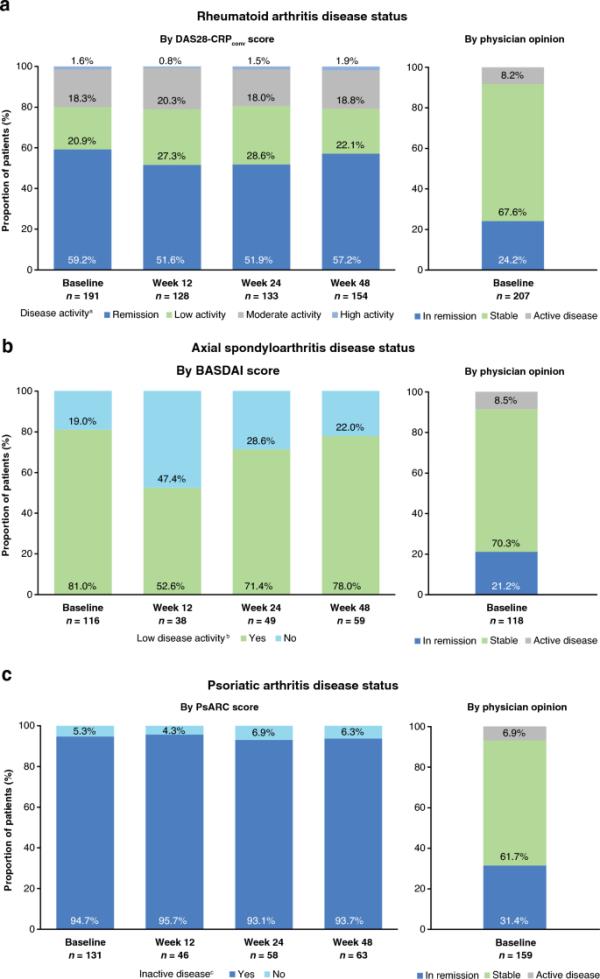

疾病活动度评分、b、c、d、e和医生意见基线时的疾病状况;a DAS28-CRPconv在RA患者,b BASDAI在axSpA患者,c PsARC在PsA患者,d HBI在CD患者,e PMS在UC患者。axSpA轴性脊柱炎,BASDAI Bath强直性脊柱炎疾病活动指数,CD克罗恩病,DAS28-CRPconv疾病活动评分,28个关节的疾病活动评分采用c反应蛋白转换,28个关节的疾病活动评分采用红细胞沉积率,HBI哈维- bradshaw指数,PMS部分梅奥评分,PsA银屑病关节炎,PsARC银屑病关节炎反应标准,RA类风湿性关节炎,UC溃疡性结肠炎。aDAS28-CRPconv:分别以≤2.4、> 2.4 - 2.9、> 2.9-4.6、> 4.6分定义缓解、低活动性、中度活动性和高活动性。bBASDAI:低疾病活动度定义为得分< 4。cPsARC:非活动性疾病定义为关节肿胀评分< 3或关节压痛评分< 3(两个评分必须可用)。dHBI:缓解、轻度活动性、中度活动性和重度活动性分别以评分< 5、5 - 7、8-16和> 16定义。e经前综合症:缓解、轻度活动、中度活动和严重活动分别以评分< 2、2 - 4、5-7和> 7来定义
在基线时,所有队列中的大多数患者以每2周一次40 mg的给药方案接受SB5治疗,在第48周基本保持不变(表S6)。
共有576名患者(60.3%)接受了至少一种伴随药物治疗,其中最常见的是RA (51.2%), axSpA(11.8%)和PsA(34.6%)队列的甲氨蝶呤,以及CD(11.4%)和UC(58.3%)队列的美萨拉嗪(表1)。
3.2 主要Objective-e对SB5持久性候选预测因子的评价
对于RA、axSpA、PsA和CD队列,48周时SB5持续可能性的Kaplan-Meier (95% CI)估计分别为0.86(0.80 - 0.90)、0.80(0.71-0.86)、0.81(0.74 - 0.76)和0.50(0.21-0.74)(由于小n,数据未显示)。女性是唯一与SB5停药可能性相关的候选预测因子。在RA、axSpA和CD组中,女性停药的风险比分别为3.53、2.38和2.21(表2)。
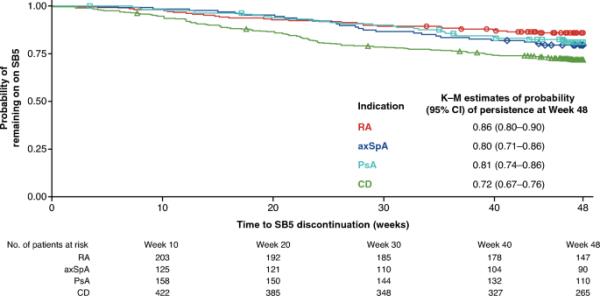
Kaplan-Meier图显示RA、axSpA、PsA和CD患者继续使用SB5的概率。纳入研究的UC患者数量太少,无法得出该队列的结论(数据未显示)。axSpA中轴性脊柱炎,CD克罗恩病,CI置信区间,K-M Kaplan-Meier, PsA银屑病关节炎,RA类风湿性关节炎
退出研究的主要原因(n = 23)是失去随访(n = 8, 0.8%)。在第48周(研究结束),722名患者(75.6%)仍在接受SB5治疗(ESM表S7)。SB5停药的主要原因是AE (n = 79, 8.3%),最常见的报告是注射部位反应(n = 66, 6.9%) (ESM表S7)。
3.3 疾病活动评分和prom随时间的变化
随着时间的推移,任何疾病队列的疾病活动性评分从基线(SB5起始时间)没有显著变化[图1(所有队列);图3 (RA、axSpA和CD队列);表3 (PsA队列)],或RA、axSpA、PsA和CD队列的PROMs (ESM表S8)。未对UC队列的prom数据进行分析。
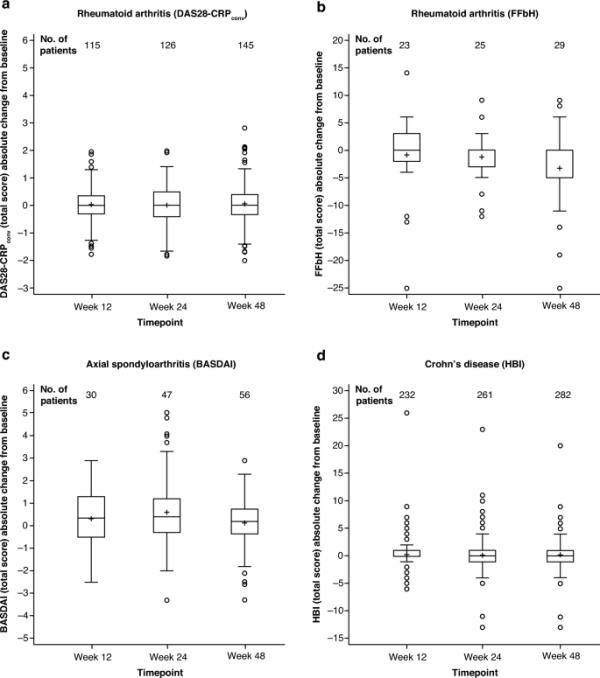
箱形图显示疾病活动性评分随时间的变化,使用适合适应症的工具测量;RA患者的DAS28-CRPconv评分为a, FFbH评分为b, axSpA患者的BASDAI评分为c, CD患者的HBI评分为d。这些图中的方框显示第一和第三四分位数;中位数用水平线表示,平均值用“+”表示;从方框向最极端点(≤四分位间距的1.5倍)画须。当个体患者在基线和随后的时间点取值时,配对得分被包括在内;每个时间点的每个图中显示有配对评分的患者数量。axSpA中轴性脊柱炎,BASDAI Bath强直性脊柱炎疾病活动指数,CD克罗恩病,DAS28-CRPconv疾病活动评分(28个关节疾病活动指数用c反应蛋白转换),FFbH汉诺威功能指数,HBI Harvey-Bradshaw指数,RA类风湿性关节炎
图1显示了第48周RA(图1a)、axSpA(图1b)、PsA(图1c)、CD(图1d)和UC(图1e)组缓解、疾病活动性低或疾病不活跃的患者比例。
3.4 免疫原性
大多数患者在基线时(n = 917/955, 96.0%未进行检测)或基线后(n = 880/955, 92.1%未进行检测)均未进行ADA检测。在基线检测的38例患者(4.0%)中,2例(0.2%)为ada阳性,36例(3.8%)为ada阴性。75名患者(7.9%)在基线后检测,只有4名患者(0.4%)也进行了基线检测;基线后结果为64例(6.7%)患者ada阴性,11例(1.2%)患者ada阳性。4例患者中有3例基线和基线后检测均为ada阴性,1例基线后血清转化检测为阴性。
3.5 安全
3.5.1 adr和sae
总共有232例患者(24.3%)报告了至少一次不良反应(表4),大多数病例的不良反应是轻微的(n = 134, 14.0%)。总的来说,最常见的不良反应是注射部位反应(n = 157, 16.4%)(表5)。在“注射部位反应”包括的情况(瘀伤、不适、外渗、血肿、出血、疼痛、瘙痒和皮疹)中,最常见的是注射部位疼痛(n = 140, 14.7%),其严重程度以轻度或中度为主。40例(4.2%)患者报告了急性呼吸道感染(sae) (ESM表S9)。RA队列中8名患者(3.9%)经历了9次SAEs,其中2次被认为与SB5有关:1名患者出现带状疱疹和肺炎。axSpA队列中的2例患者(1.6%)共经历了2次SAEs,均未被认为与SB5相关。PsA队列中有8名患者(4.9%)经历了9次SAEs;一种是呼吸困难,被认为与SB5有关。在CD队列中,22名患者(4.9%)共经历了27次SAEs,以下4例被认为与SB5有关:1例患者为肠梗阻,2例患者为肛瘘和肛周脓肿,3例患者为与阵发性室上性心动过速相关的angor。UC队列中未观察到急性脑损伤。没有致命的SAEs。
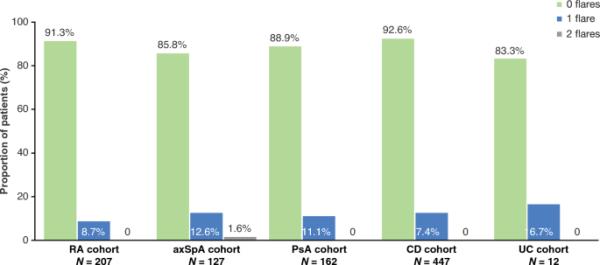
RA、axSpA、PsA、CD和UC患者的疾病发作在开始SB5治疗时或之后以及在SB5治疗前或停药时记录的疾病发作是根据研究者的临床意见来定义的,研究者记录了做出这一决定的原因(例如,疾病失去控制、症状恶化、继发性反应丧失)。axSpA中轴性脊柱炎,CD克罗恩病,PsA银屑病关节炎,RA类风湿性关节炎,UC,溃疡性结肠炎
3.5.2 疾病的耀斑
大多数患者(866/955,90.7%)在研究期间没有疾病发作,而87例患者(9.1%)经历了一次发作。只有2例患者(0.2%)经历两次耀斑发作;两名患者均在axSpA队列中(图4)。检测耀斑的最常见方式是患者报告的症状(n = 88, 96.7%)。分别有20例(22.0%)和27例(29.7%)患者需要进行与耀斑相关的生物制剂和非生物制剂剂量调整。
3.6 病人满意度
在RA、axSpA、PsA和CD组中,SB5在基线(范围:73.4-88.2%)和第48周(范围:72.0-88.7%)时更常通过笔而不是注射器给药。在UC队列中,所有12例患者(100%)在基线时通过笔给药SB5,在第48周仍在接受SB5的7例患者中继续(58.3%)。从基线到第48周,PSQ反应没有重大变化(图5)。大多数患者报告注射“简单或非常简单”(基线:55.6-83.3%;第48周:65.9-78.8%)(图5a),总体上对注射持续时间“满意或非常满意”(基线:50.0% - 75.0%;第48周:63.0-69.5%)(图5b)。笔上提示注射完成一般认为是“清楚或非常清楚”(基线:69.2-100%;第48周:73.0-87.5%)(图5c)。所有PSQ反应均在ESM表S10中提供(由于低n,不包括UC队列的结果)。
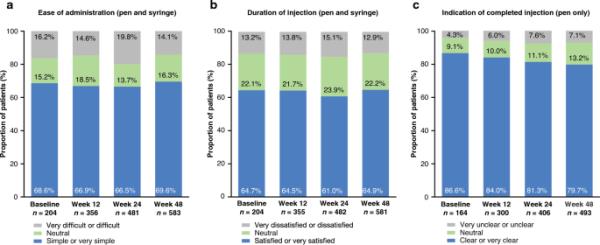
患者对SB5给药方式的满意度(来自PSQ) -所有适应症;在每个研究测量时间点,A便于给药(预充笔或预充注射器),b注射时间(预充笔或预充注射器),c完全注射适应症(仅预充笔)。PSQ患者满意度问卷
下载原文档:https://link.springer.com/content/pdf/10.1007/s40259-023-00616-3.pdf